12月3日分 復習と練習問題
1. Daniell 電池において,aZn2+ = 0.1,aCu2+ = 0.05 としたときの 25 ℃での起電力を求めよ.
Daniell 電池の亜鉛電極の電位 EZn と銅電極の電位 ECu は
EZn = EoZn/Zn2+ + {RT/(2F)} ln aZn2+
ECu = EoCu/Cu2+ + {RT/(2F)} ln aCu2+
と表すことができる.この電位は標準水素電極に対する電位であることに注意 (Eo のデータが標準水素電極基準の値で整理されているため).
実際に測定される Daniell 電池全体の起電力 Ecell は,この両電位 (EZn と ECu) の差である.したがって,
Ecell = EZn - ECu
= EoZn/Zn2+ + {RT/(2F)} ln aZn2+ - EoCu/Cu2+ + {RT/(2F)} ln aCu2+
= EoZn/Zn2+ - EoCu/Cu2+ + {RT/(2F)} ln {aZn2+ / aCu2+}
= -0.7628 - (+0.3402) + {RT/(2F)} ln(0.1/0.05)
= -1.1030 + 0.030 log(0.1/0.05)
= -1.1030 + 0.0090
= -1.0940 (V)
負号は亜鉛電極側がマイナス極であることを意味している (亜鉛から銅を引いているのだから,銅を基準に見て亜鉛がプラスなのかマイナスなのかを表す符号になっている.もちろんどちらからどちらを引いても本質的にはかまわない.符号の意味さえわかっていればいいだけである).
電位の上下関係は,数直線を使って考えると理解しやすいと思う.
なお,EoZn/Zn2+ - EoCu/Cu2+ = -1.1030 (V) をこの電池の標準起電力という.
また,25℃においては
(RT/F) ln x = (RT/F) (log x / log e) (底の変換公式)
= {(8.314×298/96500)/(0.4343)} × log x
= 0.0591 log x
したがって,n=2 においては {RT/(nF)} ln x = 0.030 log x となる.
工学系 (というか純粋数学以外のほとんどの理科系) では自然対数は ln,常用対数は log (まれには lg) で表すことが一般的である.ここでわざわざなぜ常用対数に変換しているのかと不思議に思うかもしれない.log で 1 ちがうということは,もとの数値 (この場合なら濃度) で10倍違うということであり,今の場合なら 10倍濃度を変えると 30 mV 起電力が変化するのだな,と,直感的に状況が把握しやすいという利点がある.
2. ある物質の溶液に挿入した電極に [ 電位 ] を値を変えながらかけたときに,その物質の電極反応による [ 電流 ] との関係から,その物質の酸化,あるいは還元のされやすさを知ることができる.
たとえば,二種類の還元性物質 (A とB) があり,それぞれについて,酸化の電流-電位特性の測定を行ったところ,図のような結果が得られたとしよう.
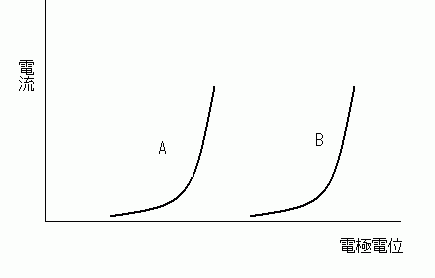
A と B ではどちらがより還元性が強い物質だと言えるだろうか.
ひとつめの空欄については「電圧」という答が多かったのだが,これについて.
電気工学等の世界では電圧と電位は必ずしもはっきりした使い分けがされておらず,事実上同義語として使われることも多い.しかし,本来の意味から考えると,電圧というのは,「電位差」と捉えるのが妥当だろう.そして,「電位」とは電気ポテンシャルのことである.電圧という用語はどこかとの差を考えているのに対し,電位は (基準点の任意性の問題はあるにせよ) 絶対的な位置を尺度を取ろうとしている.電気化学では,酸化還元反応を支配する自由エネルギーの反映として電位を考えているので,電圧というより「電位」という言葉の方が適切であろう.
3. A = A+ + e という酸化還元対考える (標準酸化還元電位 0.300 V vs SHE).今,25 ℃ において [A] = 0.100 M,[A+] = 0.0100 M を含む溶液に白金電極を挿しこみ,その電位を SHE 基準で測定した. 測定される電位は何 V か.さらに,0.280 V vs SHE になるように外部回路から電圧を印加した.このときに流れる電流はカソード電流かアノード電流か (要理由).
この状態での平衡電位は Nernst の式を用いて E = Eo + (RT/F)ln(aA+/aA) で表される.A+ が酸化体,A が還元体であることに注意.活量 a を濃度で近似すれば,この式は E = Eo + (RT/F)ln([A+]/[A]) と書ける.
R = 8.314 [J K-1 mol-1] (0.082 ではない.単位に注意),T = 298.15 [K],F = 96500 [C mol-1],さらに問題中の数値を代入すると,E = +0.241 [V] が得られる.
この状態で外部回路から +0.280 V の電位を印加するわけだが,0.280 V という電位になるためにはこの系では [A+] を増やすか [A] を減らすか,あるいはその両方をおこせばよいことが Nernst の式からわかる.反応はそのような状態になろうとする方向におこるので,正味は A → A+ + e の反応がおこるはずであり,電流は電極に電子が取り込まれる方向,つまりアノード電流が流れる.
4. 電気化学は物質の [ 酸化還元 ] 特性に関する情報を電気信号の形で得ることができる.また電気的にその状態を制御することも可能であるため,様々なデバイスの作成にも利用されている.電気化学的な原理に基づくデバイスの例を三つ挙げよ.
デバイス例: 乾電池,燃料電池,各種の充電池,pH 測定用ガラス電極,エレクトロクロミック表示素子,電解コンデンサ,電気二重層コンデンサ,etc,etc,
多かった答に,キャパシタと表示素子があった.しかしこれらは電気化学を利用したものもあれば,利用しないものもある.そういう意味では,この問の答としては不適当だろう.
